无染色
原因 | 解决办法 |
一抗和二抗不匹配 | 使用针对一抗的二抗(如一抗来自兔,二抗为抗兔抗体) |
没有足够的一抗与目标蛋白结合 | 提高一抗用量。延长4℃孵育时间(如过夜) |
由于不当储存、稀释或反复冻融造成一抗/二抗试剂盒失效 | 做阳性对照确认一抗/二抗试剂盒的有效性 |
样本中没有目标蛋白 | 建议做阳性对照 |
目标蛋白含量太少 | 应用信号放大操作 |
脱蜡不彻底 | 延长脱蜡时间,更换二甲苯 |
固定液封闭了抗体识别表位 | 缩短固定时间,加强抗原修复 |
蛋白位于细胞核内(核蛋白),抗体不能穿透核膜 | 对样本进行破膜通透处理 |
PBS缓冲液被细菌污染后破坏了靶蛋白的磷酸根 | 在抗体PBS储存液中加入适量防腐剂,或使用新鲜无菌的PBS |
高背景
原因 | 解决办法 |
封闭不充分 | 选择合适的封闭液,延长封闭时间 |
一抗浓度过高 | 针对一抗做浓度梯度实验,选择合适浓度 |
孵育温度过高,时间过长 | 选择4℃过夜或缩短孵育时间 |
二抗质量不佳 | 不加一抗,做二抗对照,选择合格二抗 |
组织冲洗不彻底 | 加强洗涤 |
内源性过氧化物酶含量过高 | 延长3%H2O2灭活时间或用0.5%高碘酸溶液室温孵育10min |
固定过度 | 改变抗原修复方法或减小抗原修复强度。 |
信号过度放大 | 缩短抗体孵育时间 |
通透作用破坏膜并除去了膜蛋白 | 去除缓冲液中的通透剂 |
显色底物过量或显色时间太长 | 缩短底物孵育时间 |
非特异性染色
原因 | 解决办法 |
一抗/二抗浓度过高 | 降低抗体浓度和或缩短孵育时间 |
存在内源性过氧化物酶活性 | 延长3%H2O2灭活时间或用0.5%高碘酸溶液室温孵育10min |
一抗与被染组织同源(如用鼠一抗检测鼠组织),加二抗后,二抗会与同源的所有组织结合 | 应用与组织非同源的一抗 |
切片/细胞变干 | 保持切片/细胞湿度,切勿变干。 |
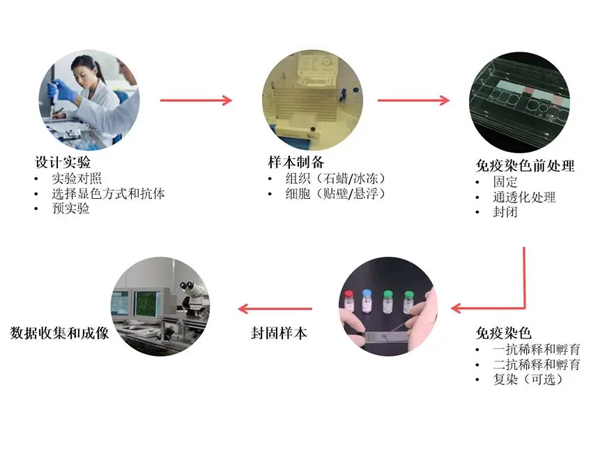
HE染色流程图